


去除腺相关病毒 (AAV) 生产过程中产生的杂质是重要的一步,因为杂质进入体内后会带来严重的不良健康反应的风险。此外,杂质也会降低制备过程的回收率,从而最终影响AAV生产过程的经济效益。
主要杂质包括宿主细胞核酸、宿主细胞蛋白(包括令人生畏的染色质形式)、衣壳聚集体、衣壳-DNA 复合物、以及具有不同核酸填充物不同组合的衣壳(从部分完整衣壳(partial capsid)装载到包含进宿主细胞 DNA )。
如果说空/实衣壳分离前的步骤(优化宿主细胞中的AAV生产,裂解,色谱前步骤,如固相萃取 – 检查Kryptonase,絮凝,酸化,疏水交换色谱,超滤/渗滤和AAV捕获 - 如CIMmultus SO3阳离子交换或亲和层析)主要是针对宿主细胞DNA和不同形状和形式的宿主蛋白,那么实衣壳分离就是接下来的第二个任务, 也就是抛光步骤。
需要补充的一点是,没有适用于所有生产工艺的标准流程。不同的AAV血清型,宿主细胞的选择,裂解方案以及下游的不同步骤会产生独特的样品,必须根据样品定制实衣壳分离方案。
▼
色谱分离方法工具箱
为此,我们开发了一个色谱分离方法工具箱,可用于寻求最佳纯度和回收率。下面的研究结果是在分析型色谱柱(CIMac系列)上进行的,其中注入了CEX-SO3纯化的样品。通过这些结果也可用于了解生产规模上使用 CIMmultus的情况(尽管考虑到分辨率略有下降 - 分析柱已根据分辨率进行了优化)。
CIMac™ AAV Empty/Full(等同:CIMmultus QA)是一种基于季胺(QA)的色谱柱(一种强阴离子交换柱),其中空衣壳和实衣壳的分离基于衣壳群体之间的电荷差异。AAV的洗脱是在碱性缓冲液中使用NaCl梯度实现的。
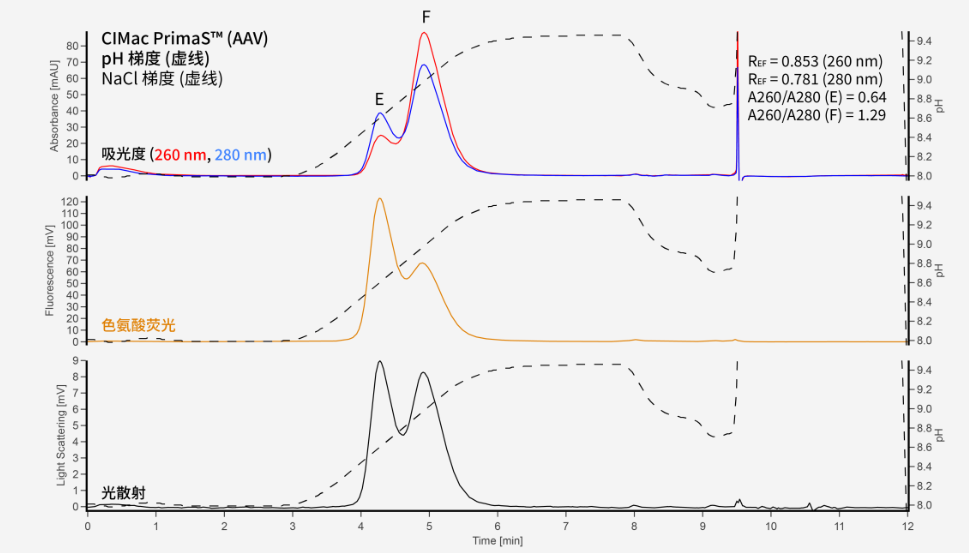
CIMac PrimaS™ Empty/Full(等同:CIMmultus PrimaS)采用离子交换-氢键多模式配基,可在pH梯度模式下分离空衣壳和实衣壳。这与季胺(QA)不同,QA中(假设所有其他条件保持不变)增加pH值会导致衣壳的强烈结合,这会导致洗脱时向更高电导率的转变。在较高的pH值下上样将增加分离效果。
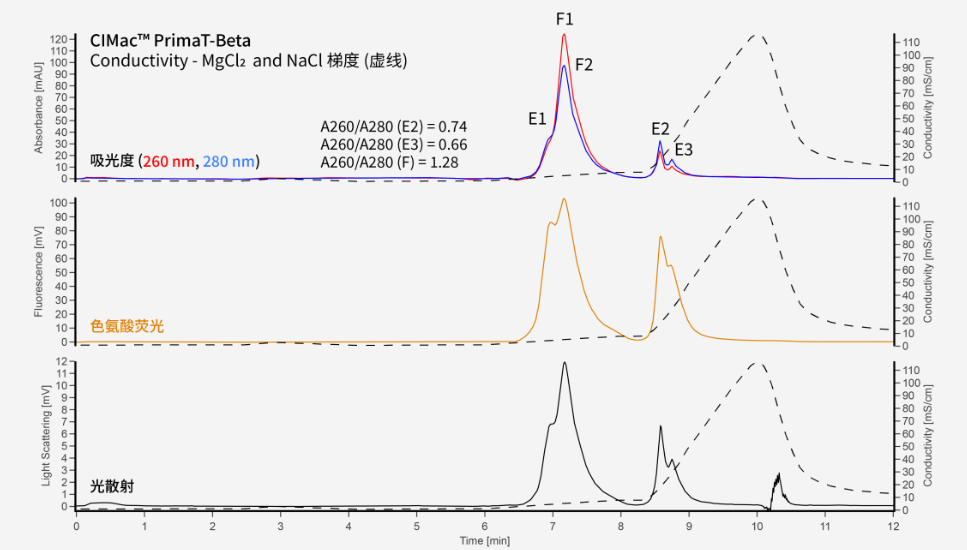
CIMac™ PrimaT-Beta(等同:CIMmultus PrimaT)是一种用于空衣壳和实衣壳完全分离的多模式色谱柱,其功能等同于弱阴离子交换柱,此外该色谱柱还通过氢键和金属离子与样品相互作用。它可以使用MgCl2和NaCl洗脱梯度的组合来分离空衣壳和实衣壳的不同亚群。
上面介绍的工作基于 Zvanut 等人的科学海报(2022),BIA Separations。
▼
方法
样品是使用CEX - CIMmultusTM SO3部分纯化的AAV2 / 8。PATfix系统(BIA Separations)用于色谱分离:
检测器设置:
电导率和pH值
吸光度(260 nm,280 nm),50mm UV流通池
荧光(激发/发射:280/348 nm)
光散射(角度:90°)
使用的色谱柱:
CIMac™ AAV Empty/Full 0.1 mL 分析柱(1.3 μm 通道);货号:110.8503-1.3
CIMac PrimaS™ Empty/Full 0.1 mL 分析柱(2 μm 通道);货号:BIA-110.8504-2
CIMac™ PrimaT 0.1 mL Beta 分析柱(2 μm 通道); 货号:BETA 0009
流动相和色谱方法
流速:1 mL/min
使用一系列结合和洗脱缓冲液(缓冲液A 30 CV、缓冲液B 30 CV、缓冲液A 30 CV)平衡色谱柱。进样后和梯度开始之前,允许20 CV的结合缓冲液。
进样前先运行3个用结合缓冲液代替的空白样品。如果电导率和pH值尚未稳定,可以运行更多。
为了减少样品残留,注入在定量限度内仍能产生结果的最小量(可能需要进行测试)。
CIMac™ AAV Empty/Full
缓冲液A:20 mM BTP + 2 mM 氯化镁 + 1 % 山梨糖醇 + 0.1 % poloxamer 188,pH 9.0
缓冲液B:20 mM BTP + 2 mM 氯化镁 + 200 mM 氯化钠 + 1% 山梨糖醇 + 0.1% poloxamer 188,pH 9.0
NaCl梯度:从100%缓冲液A到50%缓冲液B的5分钟梯度。
CIMac PrimaS™ (AAV)
缓冲液A:10 mM BTP + 10 mM TRIS + 2 mM 氯化镁 + 1 % 山梨糖醇 + 0.1% poloxamer 188,pH 8.0
缓冲液B:10 mm BTP + 10 mM TRIS + 2 mM 氯化镁 + 1 % 山梨糖醇 + 0.1 % poloxamer 188,pH 9.5*
*添加NaCl以实现缓冲液A和缓冲液B的相同电导率。
pH 梯度:从 100% 缓冲液 A 到 100% 缓冲液 B 的 2.5 分钟梯度。
CIMac™ PrimaT-Beta
缓冲液A:25 mM HEPES、1% 蔗糖、0.1 % poloxamer, pH 7.0
缓冲液B:50 mM Tris、13.6 mM 硼 盐、1 % 蔗糖、0.1 % poloxamer, pH 9.0
缓冲液C:50 mM Tris、9.6 mM 硼 盐、50 mM 氯化镁 2、1% 蔗糖、0.1 % poloxamer, pH 9.0
缓冲液D:50 mM Tris、12 mM 硼 盐、2 M 氯化钠、1% 蔗糖、0.1 % poloxamer, pH 9.0
梯度:从100%缓冲液B到100%缓冲液C的2.5分钟梯度,然后从100%缓冲液B到100%缓冲液D的2.0分钟梯度。
根据基于UV信号的标准方程计算分辨率:R = 2 tF − tE / wF + wE ,其中 tF 和 tE 是保留时间,wF 和 wE 是AAV实衣壳和空衣壳基线处的峰宽度。根据荧光计算空衣壳和实AAV衣壳的百分比(%E和%F)。将光散射添加到色谱图中进行比较。
结果和讨论
比较所有三种色谱柱的结果,估算出的AAV空壳率和实壳率是近似的,即52%空壳率和48%实壳率。在这种情况下,使用荧光信号会产生比UV更接近实际状态的结果。主要是因为与紫外线相比,荧光信号下AAV中的DNA装载对读数的影响较小,而核酸对紫外信号的吸收相当显著,因此会高估了实衣壳的比例。荧光信号可实现更微量级别的检测和定量。
然而事情并不这么简单。色谱分离的不同目的意味着我们对色谱分离也有不同的要求。对于分析目的而言,良好的分辨率,但同样重要的是测量两种衣壳的色谱峰面积的难易程度。这里基于QA色谱柱的结果显示,当使用梯度方法时,很少能提供基线分离,但是空衣壳聚集在一个峰,实衣壳聚集到另一个峰,使得进行面积测量相对容易。如果始终使用相同的标准进行定量(空衣壳峰在两峰之间的最低点结束),则误差是可重现的,因此可以保证可重现的并且可靠的分析。

PrimaS色谱柱提供轮廓相似的色谱图,其中两个峰似乎相距更远(尽管稀释倍数更高),但分辨率会降低。这确实意味着对于分析目的而言QA色谱柱可能更合适,但对于制备目的PrimaS更具有优势。补充一点,这些结论是基于已有案例,可能并非在所有情况下都是正确的——两种色谱柱都可以用于分析和制备测试。
另一方面,PrimaT色谱柱提供了非常不同的特异性,保证了空衣壳和实衣壳的不同亚群分离。根据已有的使用经验,这可能是需要的或最好避免的。对于制备目的,需要收集和分析洗脱物质的馏分,并考虑随后应如何富集这些馏分以获得最佳纯度。对于分析目的,PrimaT色谱柱确实可以让我们更深入地了解空衣壳和实衣壳的组成,但在空壳和实壳被认为是同质的情况下,可能更难进行一般性测量。我们预计未来将需要对亚种群结构有更多的了解,因此PrimaT色谱柱提供了一个可以在此类场景应用的工具。PrimaT色谱柱也可以测试用于制备目的。
一直以来,BIA Separations是质粒DNA、AAV、mRNA高效率纯化的。不仅提供整体柱及平台方法,还提供定制的纯化服务,以满足质粒DNA、AAV、mRNA规模化生产的纯化需求。