


色谱载体的类型(整体柱、树脂、膜等)、固相载体介质和使用的流动相,都会影响到分离成功与否。选择正确的工具和条件组合会带来想要的结果。然而,还有其他因素,如柱温、流动相制备的准确性以及最重要的柱平衡,这些因素对于最佳分离至关重要,但很容易被忽视,尤其是最后一个因素。
PrimaS和QA介质采用梯度洗脱(分别为电导率和pH值)方式来分离空衣壳和实衣壳。由于这种分离是基于两者之间微小的衣壳差异,因此会对色谱参数的微小变化很敏感。尤其是如果整个过程由多人操作时,其中一些参数可能不明显且分析后难以确定。为了建立认知,本文使用PrimaS介质作为模型评估了其中的几个因素。此外,本文还说明了为什么使用电导率和 pH检测器对于理解样品结果之间的不一致性非常重要。
这些结果也可考虑应用于QA介质及其他介质,然而结果会有一定程度的变化。
▼
实验方法
使用0.2 mL PrimaSTM整体柱进行方法开发,用AAV 2/8血清型样本进行检测。为了评估色谱参数,从色谱图中获取空衣壳和实衣壳的保留时间和洗脱pH值向样品中加入色氨酸,将其作为一种非结合示踪剂(流穿峰)。
PATfix® HPLC系统用于色谱实验
检测器:
pH和电导率
荧光(Ex/Em:280/348 nm)
缓冲液组成(pH梯度):
缓冲液A:10 mM BTP、10 mM(TRIS)、2 mM氯化镁(MgCl2)、1%山梨醇、0.1% poloxamer188,pH 8.00
缓冲液B:10 mM BTP、10 mM(TRIS)、10 mM氯化钠(NaCl)、2 mM 氯化镁(MgCl2)、1%山梨醇、0.1% poloxamer188,pH 9.50
梯度:从100%缓冲液A到100%缓冲液B,5.0分钟梯度。
CIP和柱平衡:10 CV 0.1 M(NaOH)和1 M氯化钠(NaCl);30 CV 0.1 M乙酸和1 M氯化钠,pH 5;20 CV双蒸水(ddH2O);20 CV缓冲液A;20 CV缓冲液B;40 CV缓冲液A
结果
温度变化对空衣壳(E)/ 实衣壳(F)分离的影响:
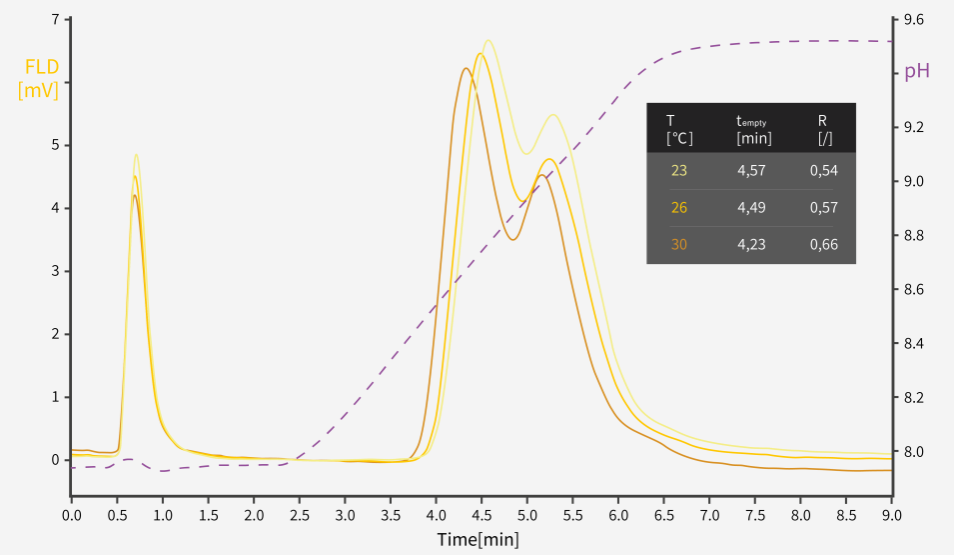
图1: 在23℃、26℃和30℃三种不同温度下进行的AAV空衣壳/实衣壳分离的色谱图
温度升高会显著提高空衣壳和实衣壳之间的分辨率,但也会影响保留时间(图 1)。虽然潜在的机制很多,但较高的温度确实会增加分子动能,进而影响分子-分子和分子-整体柱相互作用。
为了成功应用,需了解AAV结合特性(电导率、pH、T)并保持温度稳定。使用柱温箱对于提供可重现的色谱柱性能至关重要。然而我们在使用制备柱时确实需要注意这一点,它对于可重现性分析至关重要。
如果要将缓冲液置于恒温箱中,则可对其进行预热,或可以在进入色谱柱之前使用金属线圈进行预热。有些缓冲液比其他缓冲液更值得注意,因为它们的pH值容易受温度影响(如TRIS)。其他应用场景也是如此,如pDNA同种型分离非常依赖温度。
还必须控制柱温。最重要的是,冷藏过的色谱柱,应该将它预热到工作条件。
使用PrimaS柱时效果可观,但在使用CIMac AAV full/empty(QA基质)柱时也观察到效果显著。
缓冲液制备影响空衣壳/实衣壳分离:
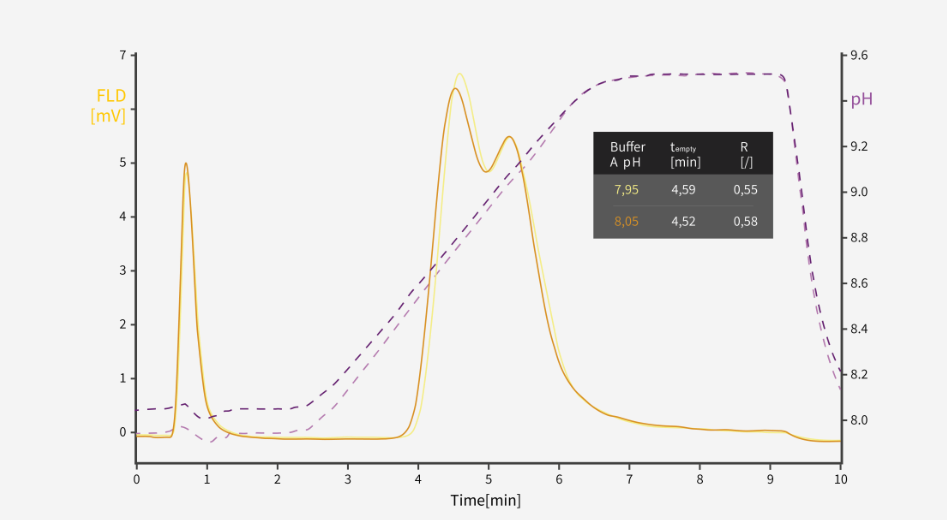
图2: 使用pH 8.00±0.05的缓冲液A进行AAV空衣壳/实衣壳分离的色谱图
缓冲液制备对分离性能有影响(图 2)。 pH 和电导率都是色谱方法优化的关键因素,因此应该严格控制。现有例子显示了 pH 值变化对分辨率和保留时间的影响。在某些情况下,影响可能比图 2 中观察到的更大。
虽然如图所示分析了 pH 值的影响,但电导率也非常重要。滴定过程中 pH 值被过度校正(pH 值降到目标值以下必须重新调高)时要注意。这会增加离子浓度,因此尽管达到了正确的 pH 值,但仍增加了电导率。在这种情况下,丢弃缓冲液并重新开始配制新缓冲液可减少阻碍。这适用于使用 PrimaS、QA 和其他基质整体柱时。
要了解并控制 pH 值及电导率对色谱分离的影响,使用 pH 计尤其是电导率检测器至关重要。缺乏此类知识会使我们变得盲目,并在分析不可重现性或其他异常现象背后原因时很难提供指导。
对于 PrimaS,pH 值的精度必须达到 1%,才能获得可重现的结果。这可通过使用精确质量标准化 的1 M HCl 调节 pH 值来实现。
柱平衡对空衣壳/实衣壳分离的影响

图3: 不同柱平衡条件下进行AAV空衣壳/实衣壳分离的色谱图
在使用制备型色谱或分析型色谱时,为了获得可重现的结果和最大化峰分辨率而采取的最简单预防措施,也是往往被忽视的一种:色谱柱平衡。 很容易观察到并再次显示在图3 中,如果色谱柱未完全平衡,峰之间的分辨率会显著降低。无论是离子交换(QA)色谱柱还是混合模式色谱柱,如 PrimaS(离子交换与氢键结合),为了适当的样品结合来准备色谱柱是必不可少的。
在进行分析时,电导率和pH检测器将帮助我们确认色谱柱是否已平衡。最好标志是与空白样品相比,电导率和 pH 信号接近基线。柱平衡后的推荐步骤是在注入样品之前上至少 3 个空白样品(或直到所有信号轨迹在运行之间可重现)。
对于制备型色谱,这主要取决于柱出口处的 pH 和电导率信号是否与柱前测量值相匹配。
开始开发使用色谱柱时严格按照说明书进行。在此过程的后期,可以根据经验优化柱平衡条件(减少特定缓冲液的 CV,或例如在平衡期间过渡到静态保持步骤——没有流速以节省缓冲液)。
值得注意的是需要在原位清洗(CIP)后中和色谱柱,尤其是在使用不同浓度的 NaOH 时。使用 1 M 乙酸钠或选择等同强度缓冲液(如在方法本身中使用的缓冲液)。继续用去离子水洗涤。之后,将平衡缓冲液用于新的色谱运行或用于作为长期储存的储存溶液。此步骤对于获得最佳柱效至关重要。如需精确的分步指导,请搜索随附的说明手册。
系统空隙体积的影响
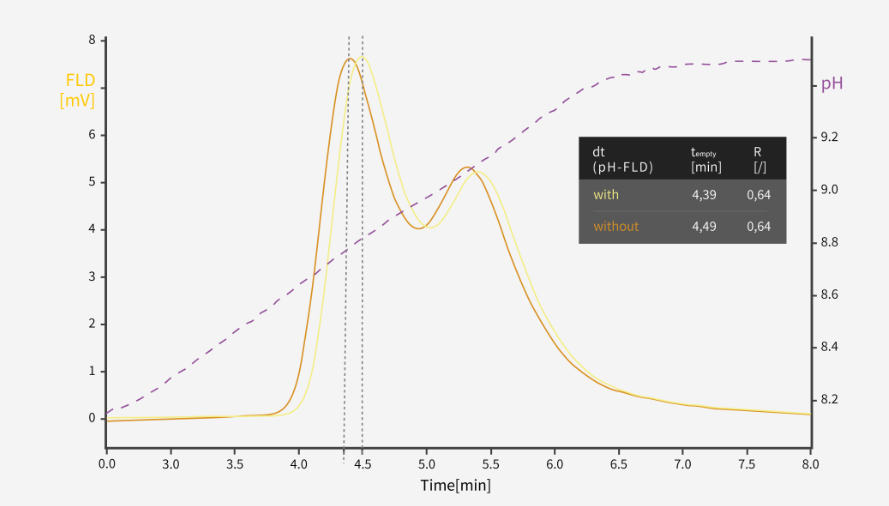
图4: 空衣壳/实衣壳AAV分离色谱图:基于检测器dt(pH-FLD)的延迟
空隙体积在解释和评价色谱参数时起着重要作用,特别是在高空隙体积系统上运行小色谱柱时,空隙体积的影响会更加显著。图 4显示了pH及荧光检测器的延迟——分析物首先通过pH检测器,再通过荧光检测器。如果采用检测器dt(pH-FLD)校正,则可获得更准确的结果。
必须考虑方法进程指示信号(例如电导率和 pH 值)与 UV、荧光或 MALS 信号之间的色谱系统配置延迟。
结论
为了在CIMac PrimaS™和CIMac AAV full/empty色谱柱上进行可重现性的AAV空衣壳/实衣壳分离,重要的是:
· 控制色谱柱、流动相和样品温度。对于色谱柱和流动相,请使用恒温箱。或在色谱柱前使用金属线圈在流动相流到色谱柱时对其进行加热(这只会加热缓冲液,对色谱柱本身作用不大)。进样前恒温样品。
· 准备缓冲液时要注意精度。设置可接受的误差以减少不受控制的波动。
· 平衡色谱柱。好的起点是遵循应用手册并根据经验进行优化。
· 考虑色谱配置条件并考虑在信号上观察到的任何延迟。
一直以来,BIA Separations是质粒DNA、AAV、mRNA高效率纯化。不仅提供整体柱及平台方法,还提供定制的纯化服务,以满足质粒DNA、AAV、mRNA规模化生产的纯化需求。